EU CTR Expert
Leer de details van de EU CTR
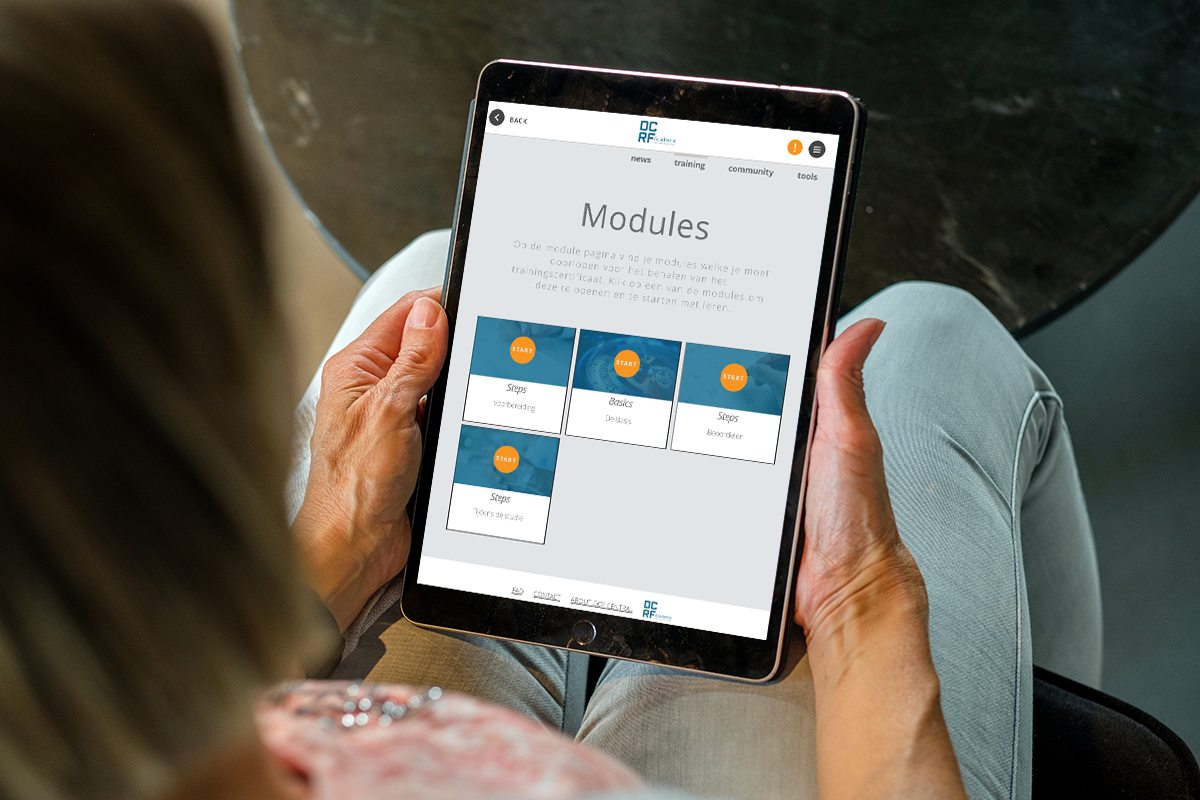
Over de EU CTR Expert e-learning






95 € excl. BTW
Vertrouwd raken met nieuwe regelgeving is niet eenvoudig. Of je nu projectmanager bent of hoofd van de ClinOps-afdeling, deze professionele e-learning voor experts helpt iedereen die het nodig heeft alle vitale aspecten van de aanstaande EU CTR-regelgeving te begrijpen. Je leert over de strategische elementen, van studieontwerp tot indiening van het dossier voor de toetsing, en de uiteindelijke uitvoering van het onderzoek.
Wacht niet tot de wetgeving van kracht is. Ga nu aan de slag met deze alles-omvattende EU CTR e-learning voor experts.
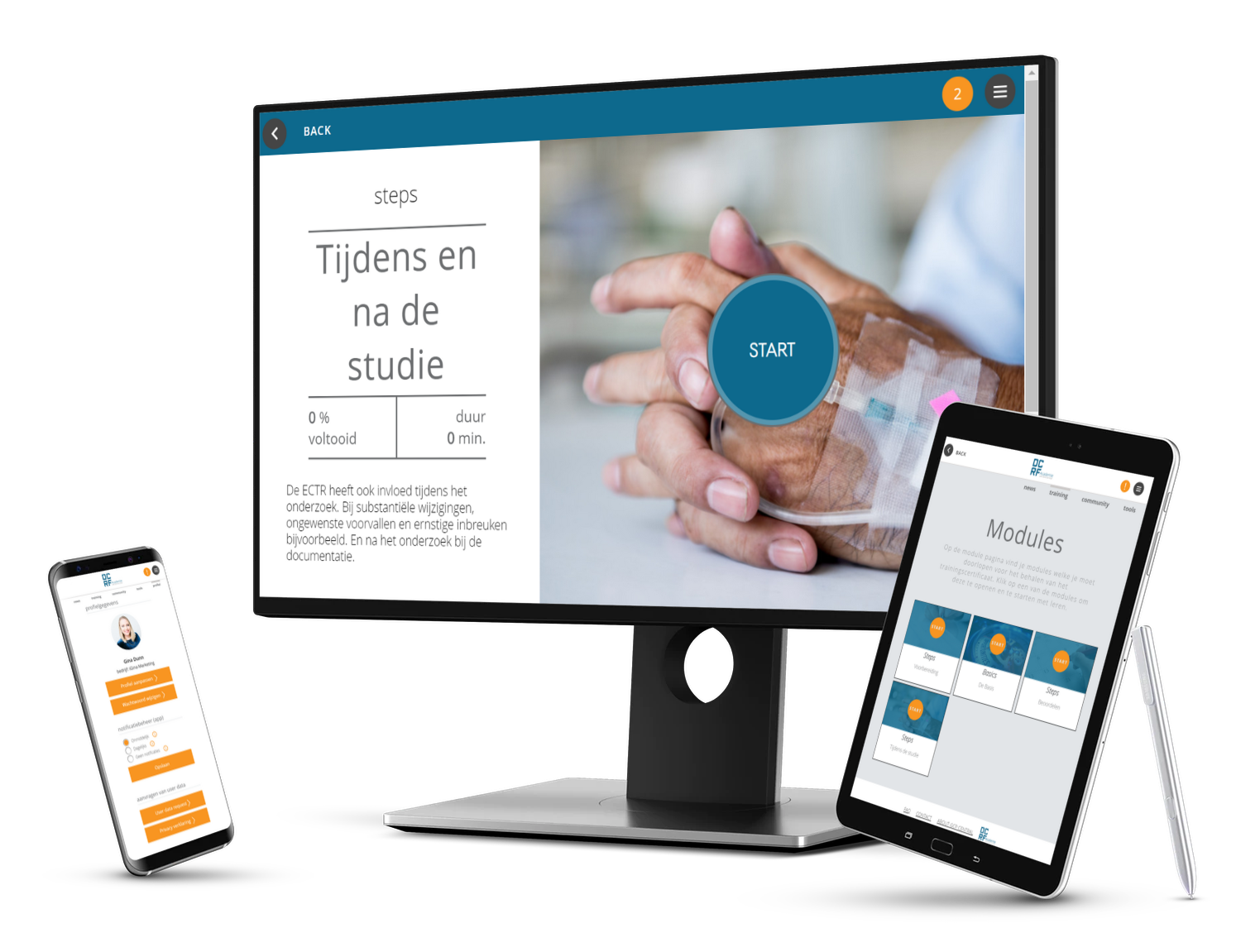

Leer alles wat er te weten is over EU CTR
De nieuwe EU CTR heeft gevolgen voor iedereen die betrokken is bij klinisch geneesmiddelenonderzoek in Nederland en helpt de samenwerking tussen alle betrokken partijen te optimaliseren. In de kern is de nieuwe wetgeving bedoeld om het opstarten en uitvoeren van onderzoek in de EU te versnellen. Wacht niet tot de wetgeving van kracht. Ga nu aan de slag met deze alles-omvattende EU CTR e-learning voor experts.
Geef je geloofwaardigheid een boost
Na succesvolle afronding van deze e-learning ontvang je een DCRF-certificaat, waaruit blijkt dat je bent getraind en beschikt over actuele kennis over de EU CTR en dat je gekwalificeerd bent om jouw taken binnen klinisch geneesmiddelenonderzoek uit te voeren volgens de eisen van de EU CTR.


Deze e-learning EU CTR Expert en VGO in Nederland is bedoeld voor iedereen die verantwoordelijk is voor productontwikkeling en -management, ontwerpen van geneesmiddelenonderzoek en/of strategische beslissingen. De e-learning biedt een allesomvattend inzicht in het werken volgens de eisen van de nieuwe regelgeving. De e-learning is perfect voor:
- Onderzoeks en wetenschapscoordinatoren
- Hoofdonderzoeker (Bedrijfs en Onderzoeker geinitieerd onderzoek)
- Medisch Directeuren
- Hoofd ClinOps
- Study Directors
- Project Managers
- CRAs
- Monitors
- Indieners dossiers
Wat ga je leren?
- Met het volgen van de e-learning:
Begrijp de Basis
Kun je alle wat- en waarom-vragen over de EU CTR beantwoorden.
Duidelijkheid over rollen en processen
Krijg je duidelijk inzicht in de rol van de toetsingscommissies, VGO, de rol van het Landelijk Bureau en in het totale beoordelingsproces.
Patiënteninformatie
Leer je alle eisen aan het informeren van patiënten.
Indieningsproces en strategieën
Leer je de ins- en outs van het aanvraag- en beoordelingsproces en mogelijke indieningsstrategieën voor je klinisch geneesmiddelenonderzoek.
Alles over optimalisatie
Leer je de juiste manier om tijdens de uitvoering van een klinisch geneesmiddelenonderzoek te werken volgens de eisen van de EU CTR. Leer je vanaf het begin tot het eind van het onderzoek, hoe te handelen bij wijzigingen, inbreuken (breaches), en het melden van ongewenste voorvallen (adverse events)
Test je kennis
Deze e-learning wordt afgesloten met een EU CTR Expert en VGO kennis toets, die onderdeel is van de online leeromgeving.
Deelnemers die deze cursus voltooien, ontvangen aan het einde van de cursus een certificaat.
Alle Trainingen